昨日は無機化学、ハロゲン分野の学習を進めていました。
その際に気になったことがあったのでブログに書いておこうと思います。
ハロゲンとは?
第17族元素(だいじゅうななぞくげんそ、仏: halogèneアロジェーヌ、英: halogen ハロゲン)は周期表において第17族に属する元素の総称。フッ素・塩素・臭素・ヨウ素・アスタチン・テネシンがこれに分類される。
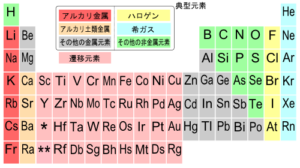
(出典:高等学校化学I/非金属元素の単体と化合物/元素と周期表)
上記に示すように、ハロゲンとは周期表の第17族に位置する元素です。
上図では黄色い元素がハロゲンですね。
ハロゲンに酸化力がある理由は?
ハロゲンの酸化力は、ハロゲンの電気陰性度の大きさと関係しています。
ハロゲンは電気陰性度が大きいため、電子を引き付ける力が強い、つまり他の物質から電子を奪いやすいため、酸化力が強くなるのです。
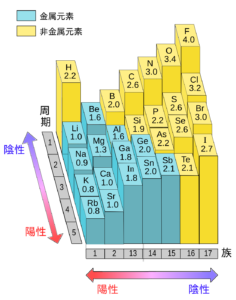
(出典:スマホでマナブサイト、スマナビング!)
ハロゲンの電気陰性度の大きさには以下の2点が影響を与えています。
- ハロゲンは閉殻構造よりも一つ電子が少ない状態なので、電子を受け取って閉殻構造になりたがっている。つまり、相手から電子を奪いたい状態にある。
- ハロゲンは希ガスを除くと周期表の一番右側に位置する。通常、同一周期では周期表の右にいくに従って有効核電荷が増大する(最外殻までの距離は変化なし)ため、核が電子を引き付ける力が強くなる。
このような理由でハロゲンの電気陰性度が高くなるため、ハロゲンは酸化力が大きいのです。
酸化剤としての働き
ハロゲンが酸化剤として働くと一体何が起こるのかを考えてみましょう。
具体的に、フッ素(F)の場合について考えてみます。
フッ素単体(F2)が酸化剤として働くときの半反応式は以下の通り。
F2 + 2e– → 2F–
つまり、フッ素単体(F2)がフッ化物イオン(2F–)になるのです。
フッ素以外のハロゲンに関しても、それぞれ対応するハロゲン化物イオンになります。
ハロゲン化物イオンの安定性
ここで、
「じゃあ、対応するハロゲン化物イオンの安定性も酸化力と関係あるんじゃないかな?」
という疑問が出てきます。
そこで、ハロゲン化物イオンの安定性について考えてみましょう。
一般的に陰イオンの安定性に影響を与えるのは以下の2点です。
- 陰イオンのサイズ
- その原子の電気陰性度
陰イオンのサイズが大きいほど負電荷が非局在化するので安定性が大きくなります。
また、原子(陰イオンとなった原子)の電気陰性度が大きいほど負電荷を取り込みやすいので、陰イオンは安定化します。
ハロゲンの場合は、上記2点のうち
「陰イオンのサイズ」
の方が陰イオンの安定性に大きく寄与することが知られています。
そのため、陰イオンのサイズと陰イオンの安定性が対応することになります。
イメージとしてはこのような感じでしょうか。
(赤丸は各要因の寄与の大きさを表しています)
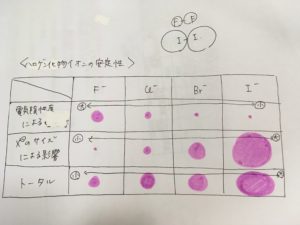
(※表の上にある図はお気になさらず・・・)
したがって、ハロゲン化物イオンの安定性は以下の通りであることが分かります。
ここでふと疑問が沸きました。
「ハロゲンの酸化力とハロゲン化物イオンの安定性、逆の関係になってないか?」
疑問点
ハロゲン単体が酸化されるとハロゲン化物イオンになるのですから、
ハロゲン化物イオンが安定なほどその単体の酸化力が高いのでは?と思っていました。
しかし実際にハロゲン単体の酸化力とハロゲン化物イオンの安定性を比較してみると、
一番酸化力の強いフッ素単体(F2)から生成するフッ化物イオン(F–)の安定性が最も低いんですよね。
酸化力の強さ:F2 > Cl2 > Br2 > I2
ハロゲン化物イオンの安定性:F– < Cl– < Br– < I–
一体なぜなのか。
私の推論を示してみたいと思います。
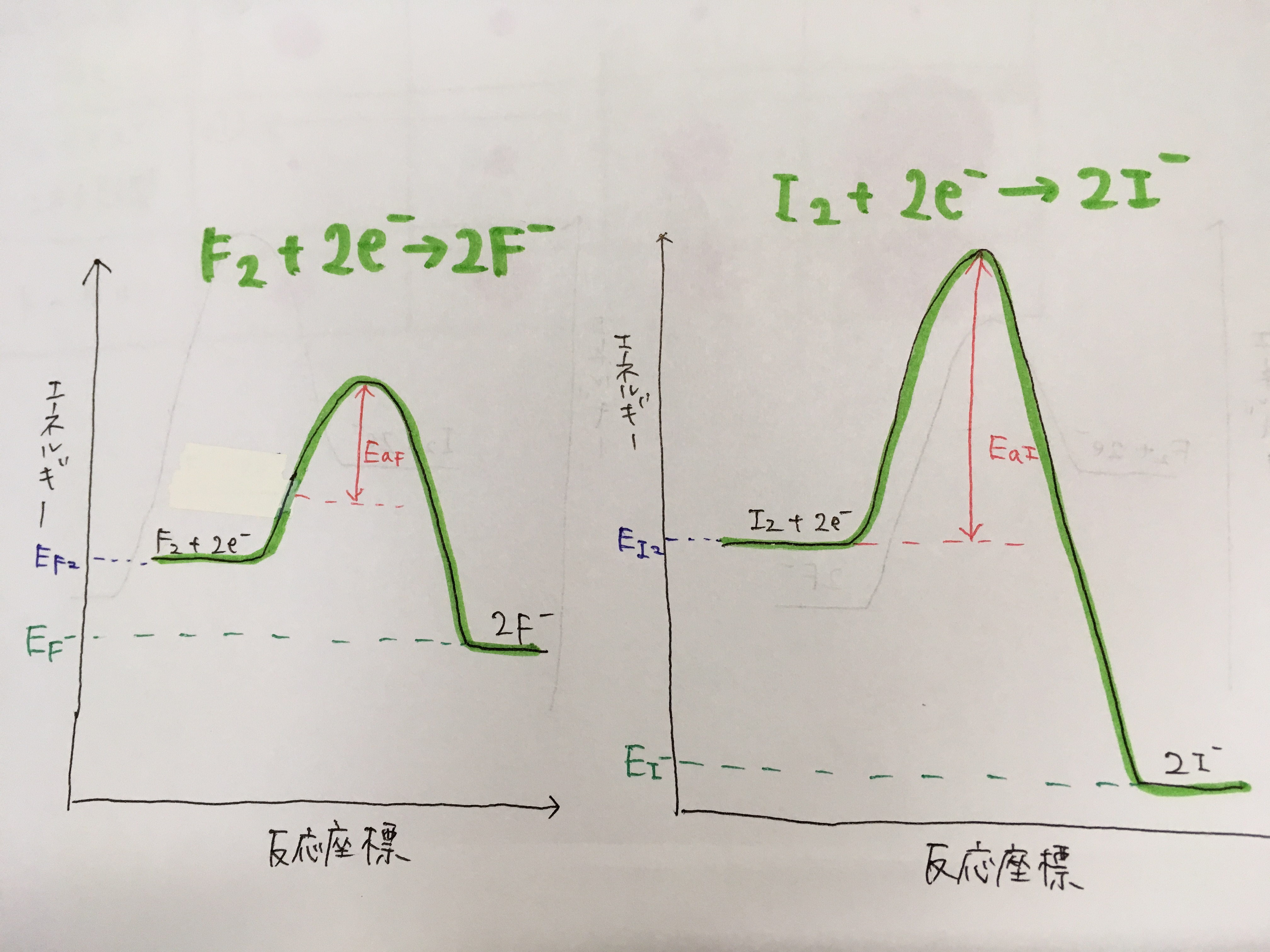
エネルギー図で考えてみた
酸化還元反応の半反応式をエネルギー図に起こして考えてみました。
酸化剤として働くときにはF2がF–に変化するため、エネルギー変化があるはずです。
そして、物質が化学変化を起こすときには必ず活性化エネルギーの壁を超える必要があります。
そう考えると、例えばフッ素とヨウ素が酸化剤として働くときのエネルギー図は
次のように表すことができるのではないでしょうか。
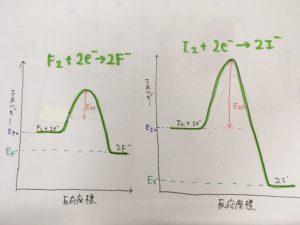
- 生成物であるF–とI–では、前述の議論によりエネルギーはF– > I–
- 活性化エネルギーは電気陰性度と相関があると考え、フッ素の反応の方が低い
と考えてみました。
つまり、
「酸化力の大小は活性化エネルギーの大小と相関があるのではないか」
という考えです。
この場合、生成物のエネルギーはF- > I-であるが、反応の活性化エネルギーから考えると
速度論的にはF2の酸化反応の方が起こりやすいとすることができます。
これが本当に正しいのかはわかりませんが、自分で自問自答していく中で
「こういう考え方もできるのではないか」
と思い、ブログに投稿させていただきました。
この件について追加情報を見つけたときには、また本記事に追記していきます!!




コメントを残す